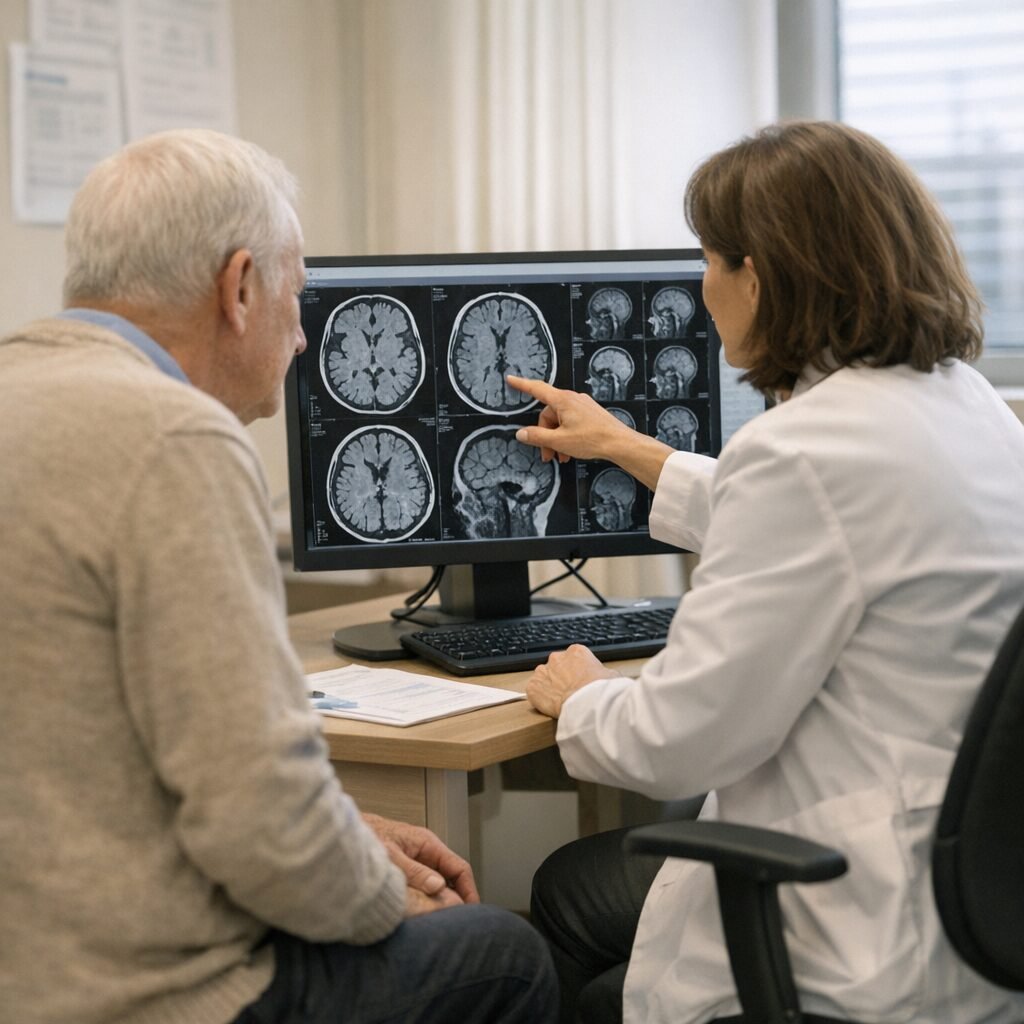
Tras años de expectativas, resultados dispares y debates sobre seguridad, la Unión Europea ha dado un paso decisivo: la Comisión Europea ha autorizado el uso de lecanemab, un tratamiento para el alzhéimer en fases iniciales. La noticia marca un punto de inflexión para miles de familias, pero también abre una etapa de preguntas prácticas: quién podrá recibirlo, cómo se detectará a tiempo la enfermedad y qué riesgos hay que vigilar.
La autorización europea llega tras la recomendación del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA), que evaluó la evidencia disponible sobre eficacia y seguridad. Lecanemab está indicado para personas con deterioro cognitivo leve o demencia leve por enfermedad de Alzheimer y con confirmación de patología amiloide, es decir, presencia de placas de beta-amiloide en el cerebro. Es un detalle crucial: no se trata de un “medicamento para cualquier alzhéimer”, sino de una terapia dirigida a un subgrupo concreto y en un momento muy temprano.
El fármaco —un anticuerpo monoclonal— actúa reduciendo la carga de amiloide, una de las dianas biológicas más estudiadas de la enfermedad. En los ensayos clínicos, su efecto se ha traducido en una ralentización modesta pero clínicamente relevante del deterioro en determinados pacientes. No es una cura, ni revierte la enfermedad, pero puede ganar tiempo funcional en actividades cotidianas cuando se inicia antes de que el daño neurológico sea mayor.
“La clave es el diagnóstico temprano: tratar tarde reduce la ventana de beneficio”, explica en conversación con este medio María S. (neuróloga en un hospital público de Madrid). “Esto nos obliga a reorganizar circuitos: memoria, pruebas de biomarcadores y seguimiento estrecho. Sin ese engranaje, la innovación se queda en el papel”.
En España, el impacto real dependerá de dos pasos posteriores: la decisión de financiación y precio (a través del Ministerio de Sanidad y los procedimientos habituales) y la capacidad del sistema para identificar candidatos. Para confirmar la presencia de amiloide se recurre a punción lumbar (biomarcadores en líquido cefalorraquídeo) o PET amiloide, una prueba avanzada disponible de forma desigual según comunidades autónomas. Además, el tratamiento requiere administración periódica (en hospital de día) y controles con resonancia magnética por el riesgo de efectos adversos específicos.
Ese riesgo tiene nombre propio en neurología: ARIA (anomalías de imagen relacionadas con amiloide), que puede manifestarse como edema cerebral o microhemorragias detectadas en resonancia. La mayoría de casos son asintomáticos o leves, pero el seguimiento es indispensable. Por eso, los protocolos europeos han puesto especial atención en seleccionar pacientes y monitorizar de manera estricta, especialmente en personas con factores de riesgo y en quienes portan ciertas variantes genéticas como APOE ε4, asociada a mayor probabilidad de ARIA.
La EMA ha subrayado la necesidad de un uso controlado y por equipos especializados. En la práctica, esto empuja a reforzar unidades de memoria, mejorar el acceso a biomarcadores y reducir listas de espera diagnósticas, un punto sensible en el SNS. “Si no aceleramos el diagnóstico, corremos el riesgo de que lleguen pacientes cuando ya no cumplen criterios”, advierte Javier L. (médico geriatra y coordinador de una unidad de deterioro cognitivo en Cataluña). “También hay que comunicar bien: no es un milagro, pero para algunas personas puede significar conservar autonomía unos meses más, y eso es enorme”.
Más allá del fármaco, la aprobación reabre un debate de salud pública: cómo detectar antes el alzhéimer sin medicalizar el olvido cotidiano. Expertos en prevención recuerdan que, mientras se despliegan estas terapias, siguen siendo relevantes los pilares de bienestar cerebral: control de hipertensión y diabetes, actividad física regular, sueño suficiente, reducción de aislamiento social y abordaje de pérdida auditiva, factores vinculados a riesgo cognitivo en múltiples investigaciones.
La innovación terapéutica también llega en un contexto de envejecimiento acelerado. En España, el alzhéimer y otras demencias ya suponen una carga sanitaria y social enorme para cuidadores y servicios. El reto ahora es doble: equidad (que el acceso no dependa del código postal) y valor (que el beneficio clínico justifique el esfuerzo organizativo y el coste). La experiencia de otros países sugiere que la implementación será gradual, priorizando centros con capacidad diagnóstica y de monitorización.
En los próximos meses, sociedades científicas y administraciones tendrán que concretar guías, criterios y circuitos. Para los pacientes y familias, el mensaje es prudente: la aprobación abre una puerta, pero el camino pasa por consultas de memoria, pruebas específicas y una evaluación individualizada. Si algo cambia desde hoy es el horizonte: el alzhéimer empieza a tener, por fin, opciones farmacológicas que obligan a repensar el diagnóstico temprano y a invertir en atención especializada. El desafío es convertir una autorización europea en beneficio real y medible en la vida diaria de las personas.